Вход и регистрация
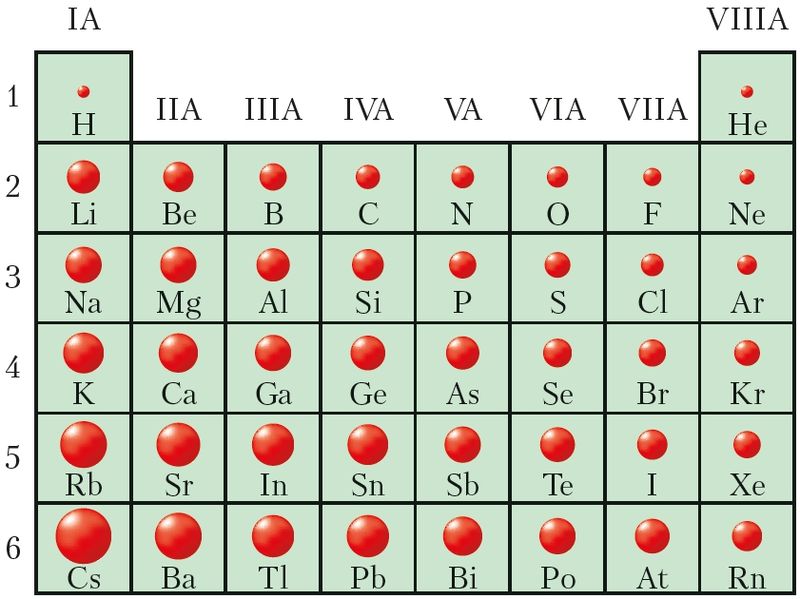
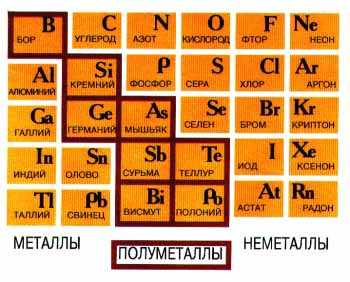
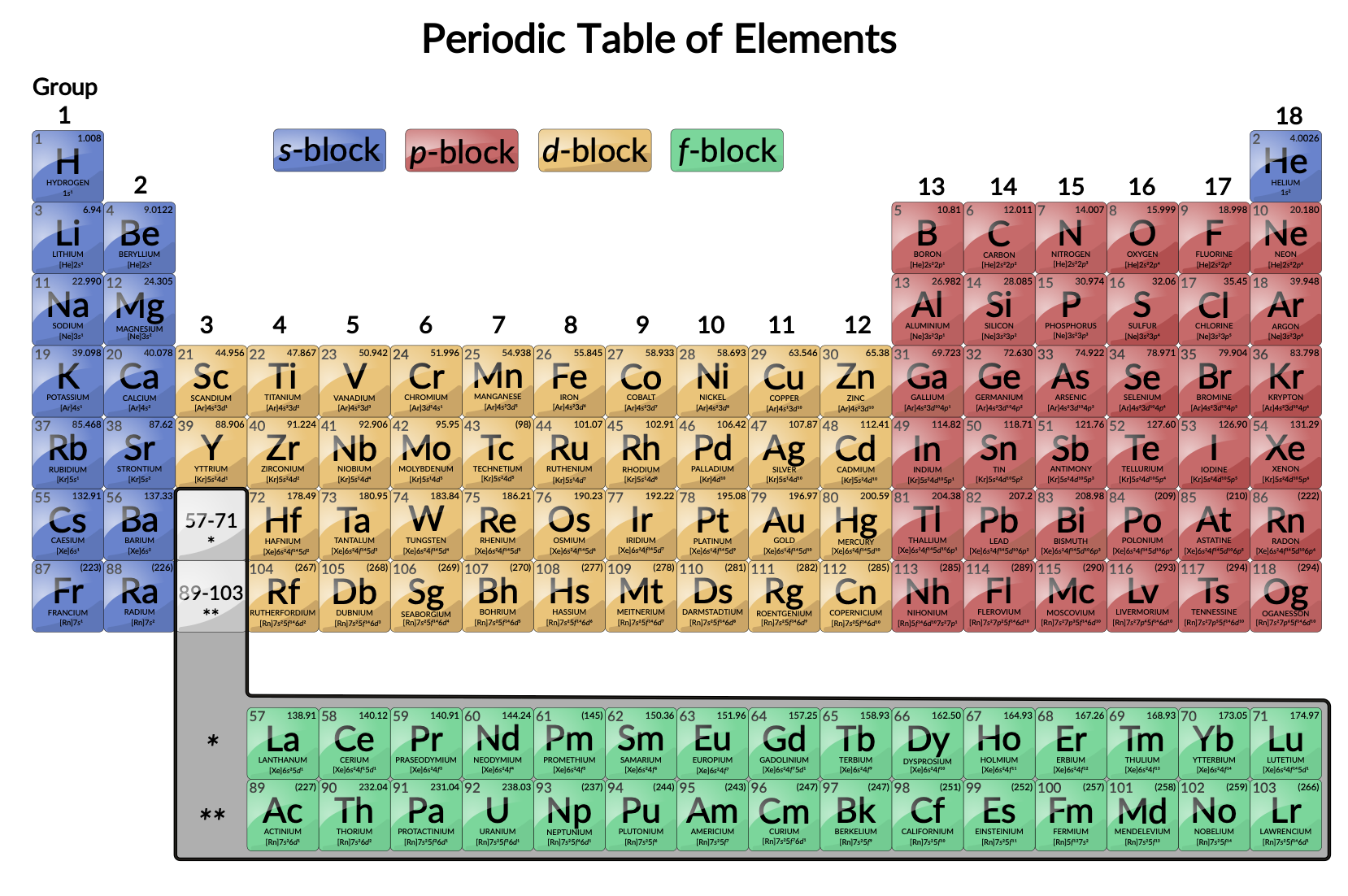
Объясните эти закономерности с точки зрения теории строения том. С возрастанием порядкового номера элемента в периоде уменьшаются металлические свойства элементов и увеличиваются неметаллические, кроме этого, в периодах малых валентность элементов в соединениях с кислородом возрастает от 1 до 7, слева направо. Эти явления объясняются строением атомов:. В главных подгруппах с возрастанием порядкового номера увеличиваются металлические свойства элементов и умень-шаются неметаллические. Это объясняется тем, что при одинаковом заряде ядра число заполненных энергетических уровней возрастает, значит увеличивается радиус атома, притяжение.

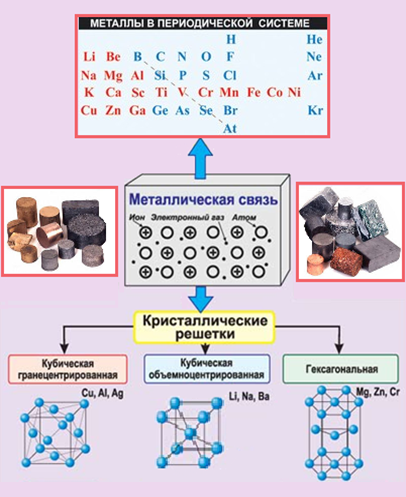
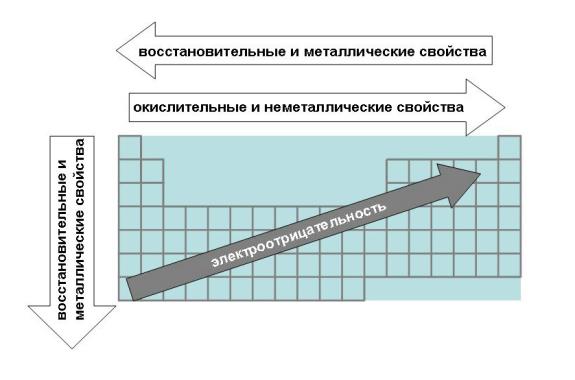



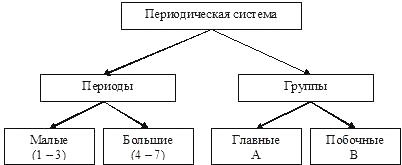
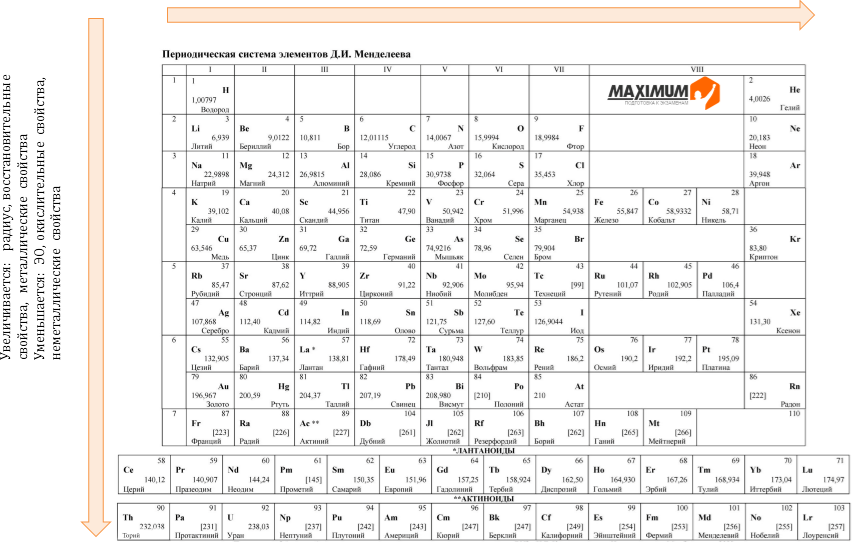


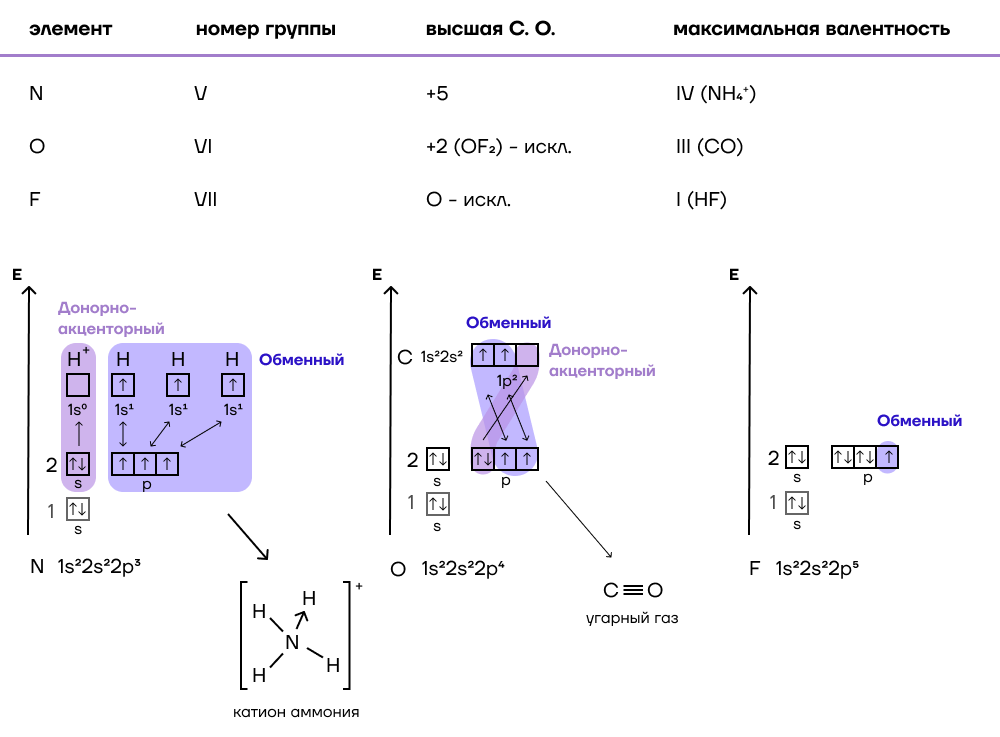
Атомы элементов одной группы имеют одинаковое строение внешней электронной оболочки. Именно поэтому такие элементы имеют сходные химические свойства. Периодический закон: « свойства химических элементов, а также образованных ими веществ находятся в периодической зависимости от заряда ядра атома». Ядру требуется больше энергии, чтобы удержать большое количество электронов, на внешнем уровне;.






Строение атома. Сварщик в городе. Почему электродами с основным покрытием не рекомендуется сваривать сверху - вниз? Влад Филатов - обзоры гаджетов и видеоигр.